Tốc độ phản ứng hóa học là một khía cạnh quan trọng không chỉ trong ngành hóa học mà còn trong đời sống hàng ngày của chúng ta. Việc hiểu và áp dụng các yếu tố ảnh hưởng đến tốc độ phản ứng không chỉ giúp chúng ta hiểu sâu hơn về thế giới xung quanh mà còn mang lại nhiều ứng dụng thiết thực trong cuộc sống hàng ngày.
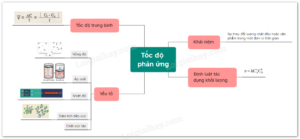
Hãy cùng với tổ Hoá học - Trường Trung học phổ thông Sài Gòn tìm hiểu các yếu tố ảnh hưởng đến tốc độ phản ứng hoá học.
Yếu Tố Ảnh Hưởng Đến Tốc Độ Phản Ứng Hóa Học:
- Nhiệt Độ: Một trong những yếu tố quan trọng nhất ảnh hưởng đến tốc độ phản ứng là nhiệt độ. Theo định luật van't Hoff, với mỗi tăng 10°C, tốc độ phản ứng tăng gấp đôi hoặc ba lần tùy thuộc vào phản ứng cụ thể. Điều này là do nhiệt độ cao giúp phân tử di chuyển nhanh hơn, tăng tần số va chạm và năng lượng va chạm, từ đó tăng tốc độ phản ứng.
- Nồng Độ: Nồng độ của các chất tham gia phản ứng cũng ảnh hưởng đến tốc độ phản ứng. Đối với các phản ứng trong dung dịch, nồng độ cao hơn sẽ tăng số lượng phân tử tham gia va chạm, từ đó tăng tốc độ phản ứng.
- Kích Thước Hạt: Kích thước hạt của chất phản ứng cũng có ảnh hưởng đến tốc độ phản ứng. Phản ứng với các hạt nhỏ hơn sẽ diễn ra nhanh hơn so với các hạt lớn do diện tích tiếp xúc lớn hơn giữa các phân tử.
- Áp Suất: Trong các phản ứng khí, áp suất cũng ảnh hưởng đến tốc độ phản ứng. Áp suất cao hơn tăng mật độ phân tử, từ đó tăng tần số va chạm và tốc độ phản ứng.
- Catalyst: Catalyst là chất xúc tác giúp tăng tốc độ phản ứng mà không bị tiêu hao trong quá trình phản ứng. Catalyst thường hoạt động bằng cách giảm năng lượng hoạt hóa của phản ứng, từ đó làm cho phản ứng diễn ra nhanh hơn.
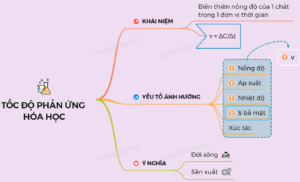
Ứng Dụng Trong Đời Sống:
- Y Học và Dược Phẩm: Trong lĩnh vực y học và dược phẩm, việc kiểm soát tốc độ phản ứng hóa học có vai trò quyết định đến hiệu quả của các loại thuốc và liệu pháp. Các nhà nghiên cứu phải thiết kế các dạng thuốc sao cho chúng có thể hấp thụ nhanh chóng và đạt đến vùng mục tiêu trong cơ thể, đồng thời giảm thiểu các tác dụng phụ không mong muốn. Các phản ứng hóa học cũng được sử dụng trong việc sản xuất các chất phản ứng với các loại virus, vi khuẩn hoặc tế bào ung thư để tiêu diệt chúng.
- Công Nghiệp và Sản Xuất: Trong công nghiệp, việc áp dụng các phản ứng hóa học là quan trọng để sản xuất ra hàng hóa với chất lượng cao và chi phí thấp. Tốc độ phản ứng được tối ưu hóa để tăng hiệu suất sản xuất và giảm thời gian sản xuất. Đồng thời, việc kiểm soát tốc độ phản ứng cũng giúp giảm thiểu lượng chất phụ gia, chất cồn hoặc các chất độc hại khác trong sản phẩm cuối cùng.
- Xử Lý Nước và Môi Trường: Trong lĩnh vực xử lý nước và môi trường, các phản ứng hóa học được sử dụng để loại bỏ các chất ô nhiễm và tạo ra nước sạch. Ví dụ, phản ứng oxy hóa khử được sử dụng để loại bỏ các chất hữu cơ và các kim loại nặng trong nước thải. Các quá trình xử lý bằng phản ứng hóa học giúp giảm thiểu tác động tiêu cực lên môi trường và cải thiện chất lượng môi trường sống.
- Năng Lượng và Nhiên Liệu: Trong ngành năng lượng, các phản ứng hóa học được sử dụng để sản xuất và chuyển đổi các loại nhiên liệu. Ví dụ, quá trình cháy và oxy hóa là các phản ứng hóa học cơ bản được sử dụng để tạo ra năng lượng từ các nguồn nhiên liệu như dầu, khí đốt và than đá. Ngoài ra, các phản ứng hóa học cũng được sử dụng để phát triển các nguồn năng lượng tái tạo như pin năng lượng mặt trời và pin nhiên liệu.
- Công Nghệ và Vật Liệu: Trong công nghệ và vật liệu, các phản ứng hóa học được sử dụng để sản xuất và cải tiến các vật liệu có tính chất đặc biệt. Ví dụ, quá trình tổng hợp polymer là một loại phản ứng hóa học quan trọng được sử dụng để sản xuất các loại nhựa và cao su có tính đàn hồi, đàn hồi và cứng nhưng dẻo
Tóm lại, việc hiểu và áp dụng các yếu tố ảnh hưởng đến tốc độ phản ứng hóa học không chỉ quan trọng trong ngành hóa học mà còn mang lại nhiều ứng dụng thiết thực trong đời sống hàng ngày của chúng ta. Từ việc nấu ăn đến sản xuất công nghiệp và bảo vệ môi trường, tốc độ phản ứng hóa học đóng vai trò quan trọng trong mọi khía cạnh của cuộc sống.





